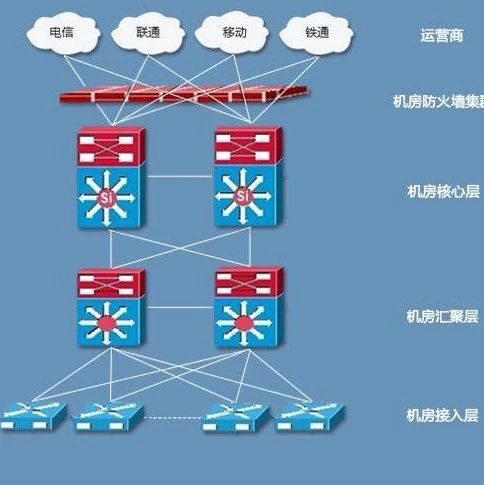
双线桥法方程式大全2hgo=2hgo2的双线桥方法
双线桥表示:KCLO3+6HCl=KCL+3CL2+3H2O
失5×e-
———————
丨 ↓
KClO3+6HCl====KCl+3Cl2↑+3H2O
丨 ↑
———————————
得1×5e- 双线桥得失电子总数=某元素化合价变化数(高价-低价,等号左边与右边之间)×发生化合价变化的该元素原子的总数(在反应物处可计算)
高中化学必修一所有化学方程式及离子方程式及氧化还原反应带双线桥的方程式 人教版
1、 硫酸根离子的检验:
BaCl2 + Na2SO4 = BaSO4↓+ 2NaCl
SO42- + Ba2+ == BaSO4↓
2、 碳酸根离子的检验:
CaCl2 + Na2CO3 = CaCO3↓ + 2NaCl
CO32- + Ca2+== CaCO3↓
3、 碳酸钠与盐酸反应:
Na2CO3 + 2HCl = 2NaCl + H2O + CO2↑
CO32- + 2H+== CO2↑+ H2O
4、木炭还原氧化铜:
2CuO + C=高温=2Cu + CO2↑
5、钠与非金属单质反应:
4Na+O2=2Na2O
2Na+O2 =加热=Na2O2
Cl2 +2Na=点燃= 2NaCl
6、钠与水反应:
2Na+2H2O=2NaOH+H2↑
2Na + 2H2O == 2Na+ + 2OH- + H2↑
7、氧化钠的主要化学性质:
2Na2O+O2 =加热=2Na2O2
Na2O+H2O=2NaOH
Na2O+SO3=Na2SO4
Na2O+CO2=Na2CO3
Na2O+2HCl=2NaCl+H2O
8、过氧化钠的主要反应:
2Na2O2+2H2O=4NaOH+O2↑
2Na2O2+2CO2=2Na2CO3+O2
Na2O2+H2SO4(冷、稀)=Na2SO4+H2O2
9、氯气的主要化学性质:
Cl2 +H2 =点燃= 2HCl (或光照)
3Cl2 +2P=点燃= 2PCl3
Cl2 +PCl3=点燃= PCl5
3Cl2 +2Fe =点燃=2FeCl3
Cl2 +2Na=点燃= 2NaCl
Cl2+Cu =点燃=CuCl2
Cl2 +2FeCl2 =2FeCl3
Cl2 + 2Fe2+ == 2Fe3+ + 2Cl-
Cl2 + 2NaBr = Br2 + 2NaCl
Cl2 + 2Br- = Br2 + 2Cl-
Cl2 + 2KI =2KCl + I2
Cl2 + 2I- == 2Cl- + I2
Cl2+H2O=HCl +HClO
Cl2 + H2O == Cl- + H+ + HClO
2HClO = 2HCl + O2↑
Cl2+SO2 +2H2O=H2SO4 +2HCl
Cl2 + SO2 + 2H2O == 2Cl- + SO42- + 4H+
Cl2+2NaOH=NaCl+NaClO+H2O
Cl2 + 2OH- == Cl- + ClO- + H2O
2Cl2+2Ca(OH)2=CaCl2+Ca(ClO)2+2H2O
2Ca(OH)2+2Cl2=2Ca2++2ClO-+2Cl-+2H2O
Ca(ClO)2+CO2+H2O=CaCO3↓+2HClO
Ca2++2ClO-+CO2+H2O=CaCO3↓+ 2HClO
10、铁及其化合物的主要化学性质:
2Fe + 3Cl2=点燃= 2FeCl3
3Fe + 2O2=点燃= Fe3O4
Fe + S= FeS
3Fe+4H2O(g)=Fe3O4+4H2
Fe+2HCl=FeCl2+H2↑
Fe+2H+ = Fe2+ + H2↑
Fe + CuSO4 = FeSO4 + Cu
Fe + Cu2+ = Fe2+ + Cu
4Fe(OH)
2 + O2 + 2H2O ==
4 Fe(OH)3
2Fe(OH)3=加热= Fe2O3+3H2O
2FeCl2 + Cl2=2FeCl3
2FeCl3+Fe=3FeCl2
2FeCl3+Cu=2FeCl2+CuCl2
FeCl3 + 3KSCN == Fe(SCN)
3 + 3KCl
Fe3+ + 3SCN- == Fe(SCN)3(红色溶液)
Fe + 2Fe3+ == 3Fe2+
2Fe3+ + Cu == 2Fe2+ + Cu2+
Fe3+ + 3OH- == Fe(OH)3↓
11、碳及其化合物的主要化学性质:
2C+O2(少量) =点燃= 2CO
C+O2(足量) =点燃=CO2
C+CO2=高温= 2CO
C+H2O=高温= CO+H2(生成水煤气)
C+2H2SO4(浓)=CO2↑+2SO2↑+2H2O
C +4HNO3(浓)=CO2↑+4NO2↑+2H2O
2CO+O2=点燃= 2CO2
CO+CuO =加热=Cu+CO2
3CO+Fe2O3=高温= 2Fe+3CO2
CO2+H2O=H2CO3
CO2+Ca(OH)2(过量)=CaCO3↓+H2O
Ca2+ + 2OH-+ CO2 == CaCO3↓ + H2O
CO2 + 2OH- == CO32- + H2O
2CO2(过量)+Ca(OH)2=Ca(HCO3)2
CO2 + OH- == HCO3-
CO2+NH3+NaCl+H2O=NaHCO3↓+NH4Cl(侯氏制碱法)
Si+2NaOH+H2O=Na2SiO3+2H2↑
12、氮气、氨气及硝酸的主要化学性质:
N2+3H2 ==2NH3
N2+O2 = 2NO
N2+3Mg=点燃= Mg3N2
2NO+O2=2NO2
3NO2+H2O=2HNO3+NO
4NH3+5O2 ==4NO+6H2O
NH3+HCl=NH4Cl(白烟)
NH3 + H2O=NH3•H2O <==> NH4+ + OH-
NH4HCO3=NH3↑+H2O+CO2↑
NH4Cl =NH3+HCl
2NH4Cl + Ca(OH)2= CaCl2 + NH3↑ + H2O
NH4+ + OH- = NH3↑+ H2O
4HNO3== 4NO2↑+O2↑+2H2O
4HNO3(浓)+C==CO2↑+4NO2↑+2H2O
4HNO3+Cu=Cu(NO3)2+2NO2↑+2H2 2NO3-
+ Cu + 4H+ == Cu2+ + 2NO2↑+ 2H2O
8HNO3+3Cu=3Cu(NO3)2+2NO↑+4H2O 2NO3-
+ 3Cu + 8H+ == 3Cu2+ + 2NO↑+ 4H2O
13、硫及其化合物的化学性质:
S+H2== H2S
S+Fe== FeS
S+2Cu ==Cu2S
S+O2 ==SO2
3S+6NaOH== 2Na2S+Na2SO3+3H2O 3S +
6OH-== 2S2- + SO32- + 3H2O
SO2 + 2H2S=3S+2H2O
SO2+H2O=H2SO3
2NaOH+SO2(少量)=Na2SO3+H2O
SO2 + 2OH- == SO32- + H2O
NaOH+SO2(足量)=NaHSO3
SO2 + OH- == HSO3-
2SO2+O2== 2SO3
2H2SO4(浓)+C== CO2 ↑ +2SO2↑+2H2O
2H2SO4(浓)+Cu ==CuSO4+SO2↑+2H2O
Na2SO3+H2SO4 = Na2SO4+ SO2↑+
H2O SO32- + 2H+ == SO2↑+ H2O
14、铝及其化合物主要化学性质:
4Al+3O2== 2Al2O3(纯氧)
2Al+Fe2O3 ==Al2O3+2Fe
2Al+3H2SO4=Al2(SO4)3+3H2↑
2Al + 6H+ = 2Al3+ + 3H2↑
2Al+2NaOH+2H2O=2NaAlO2+3H2↑或2Al+2NaOH+6H2O=2Na[Al(OH)4]+3H2↑
2Al+2OH—+6H2O=2[Al(OH)4]—+3H2↑
Al2O3+3H2SO4=Al2(SO4)3+3H2O
Al2O3+6H+=2Al3++3H2O
Al2O3+2NaOH+3H2O=2Na[Al(OH)4]
Al2O3+2OH—+3H2O=2[Al(OH)4]—
2Al2O3(熔融)== 3O2↑ + 4Al
2Al(OH)3== Al2O3+3H2O
Al(OH)3+3HCl=AlCl3+3H2O
Al(OH)3+3H+=Al3++3H2O
Al(OH)3+NaOH=Na[Al(OH)4]
Al(OH)3+OH—=[Al(OH)4]—
AlCl3+3NaOH=Al(OH)3↓+3NaCl
Al3+ + 3OH- == Al(OH)3↓
AlCl3+3NH3•H2O=Al(OH)3↓+3NH4Cl Al3+
+ 3NH3•H2O == Al(OH)3↓+ 3NH4+
AlCl3+3NaHCO3=Al(OH)3↓+3CO2↑
Al3+ + 3HCO3- == Al(OH)3↓ + 3CO2↑
扩展资料
化学方程式配平方法
一、最小公倍数法
这种方法适合于常见的难度不大的化学方程式。例如在KClO₃→KCl+O₂↑这个反应式中右边氧原子个数为
2,左边是
3,则最小公倍数为
6,因此KClO₃前系数应配
2,O₂前配
3,式子变为:2KClO₃→2KCl+3O₂↑,由于左边钾原子和氯原子数变为2个,则KCl前应配系数
2,短线改为等号,标明条件即可。
二、奇偶配平法
1、首先, 找出化学方程式左右两端原子数最多的某一只出现一次的元素, 求出它们的最小公倍数。
2、其次, 将此最小公倍数分别除以左右两边原来的原子数, 所得之商值, 就分别是它们所在化学式的化学计量数。
3、然后, 依据已确定的物质化学式的化学计量数、推导并求出化学式的化学计量数, 直至将化学方程式配平为止。
三、观察配平
有时方程式中会出现一种化学式比较复杂的物质,我们可通过这个复杂的分子去推其他化学式的系数,例如:Fe+H₂O──Fe₃O₄+H₂,Fe₃O₄化学式较复杂,显然,Fe₃O₄中Fe来源于单质Fe,O来自于H₂
O,则Fe前配
3,H₂O前配
4,则式子为:3Fe+4H₂O=Fe3O₄+H₂由此推出H₂系数为
4,写明条件,短线改为等号即可。
四、奇数配偶法
出现最多寻奇数,再将奇数变为偶。
观察配平道理简,二四不行再求
六。
把式子两边原子个数为一奇一偶的元素作为第一配平对象(若有几种元素在式子都是一奇一偶, 将出现次数较多或数目较大的那种元素作为第一配平对象)。 从含有该元素原子个数为奇数的化学式入手, 在其化学式前配上计量数, 使其变为偶数。
五、万能配平法(待定系数法)
英文字母表示数,质电守恒方程组。
某项为一解方程,若有分数去分母。
六、得失法
电子得失法的原理是:氧化还原反应中,还原剂失去电子的总数必须等于氧化剂获得电子的总数。根据这一规则,可以配平氧化还原反应方程式。
下面是配平的具体方法:
1、从反应式里找出氧化剂和还原剂,并标明被氧化元素或还原元素的原子在反应前后化合价发生变化的情况,以便确定它们的电子得失数。
2、使得失电子数相等,由此确定氧化剂和还原剂等有关物质化学式的系数。
3、由已得的系数,判定其它物质的系数,由此得配平的反应式。
氯化铁和铁的氧化还原反应双线桥法
根据化学方程式Fe+2FeCl3=3FeCl2
Fe化合价从0价升高到FeCl2中的+2价,总共升高2价,失去2个电子
2FeCl3中的Fe从+3价降低到FeCl2中Fe的+2价,1个Fe3+ 降低1价,总共降低2价,即得到2个电子
双线桥:Fe-----------FeCl2 桥上写失去1*2e-
FeCl3--------FeCl2 桥上写得到2*e-
2hgo=2hg o2的双线桥方法
前一个Hg指向后一个Hg写得2*2e-
前一个O指向后一个O2写失2*2e-
页面地址:http://www.youmibao.com/d/27186/3031.html